MD-asetus

MD-asetuksen (EU 2017/745) soveltaminen alkoi neljän vuoden siirtymäajan jälkeen 26.5.2021. Asetus korvasi vanhat direktiivit lääkinnällisistä laitteista (MDD) sekä implantoitavista laitteista (AIMDD).
MD-asetuksen alkuperäistä siirtymäaikaa siirrettiin maailmaa kohdanneen koronapandemian vuoksi vuodella eteenpäin. Asetus sisälsi runsaasti uusia velvoitteita niin valmistajille, valtuutetuille edustajille, maahantuojille kuin jakelijoillekin.
Uusi MD-asetus koskee laajuudeltaan aiempaa useampia tuotetyyppejä ja toi sääntelyn piiriin sellaisia tuotteita, joita ei ole aikaisemmin säännelty lääkinnällisinä laitteina. Katso tarkempi kuvaus lääkinnällisistä laitteista täältä.
Esimerkkejä MD-asetuksen tuomista muutoksista
- Pakollinen laatujärjestelmä kaikille valmistajille riskiluokasta riippumatta
- Pakollinen vaatimustenmukaisuudesta vastaava henkilö (Person Responsible for Regulatory Compliance, PRRC)
- Pakollinen rekisteröinti EUDAMED-tietokantaan (koskee toimijoita, laitteita, ilmoitettuja laitoksia, kliinisiä tutkimuksia, vaaratilanteita sekä markkinavalvontaa
- Ohjelmistotuotteet nousevat yleisesti korkeampaan riskiluokkaan
- Valmistajien, valtuutettujen edustajien, maahantuojien ja jakelijoiden välinen työnjako määritellään MDR:ssä ja edellyttää, että sopimuksin määritellään yksilöidysti kuka tekee mitä ja missä tilanteissa sekä määritellään vastuut asetuksen vaatimuksia vastaavasti
- Valmistajille tulee pakollista raportointia, esim. PSUR, PMSP, PMSR, SSCP ja PMCF.
- Kyberturvallisuus on lisätty turvallisuusvaatimuksiin
- Laitteiden jäljitettävyyttä parannetaan edellyttämällä, että jokaisella laitteella on yksilöllinen tunniste, UDI-tunniste (Unique Device Identifyer).
- Ilmoitettujen laitosten nimeäminen
Armon aika eli ns. grace period
Armon ajalla tarkoitetaan 26.5.2021 - 26.5.2024 välistä aikaa, jolloin markkinoille voi edelleen saattaa asetuksia edeltävien direktiivien (AIMDD ja MDD) mukaisia laitteita. Tätä poikkeusta voi hyödyntää edellyttäen, että:
- laitteella on voimassa oleva ilmoitetun laitoksen sertifikaatti ja sertifikaatin myöntänyt taho (joka ei jatka ilmoitettuna laitoksena) jatkaa valmistuksen valvontaa
- laitteelle on myönnetty vaatimustenmukaisuustodistus ennen 26.5.2021
- laitteen MDDn mukainen riskiluokka on I ja MDR edellyttäisi ilmoitetun laitoksen arviointia (eli riskiluokka nousee)
On huomattava, että mikäli valmistaja haluaa hyödyntää armon aikaa, laitteen suunnittelussa tai käyttötarkoituksessa ei saa tapahtua merkittäviä muutoksia.
MDR vaatimusten soveltaminen direktiivien mukaisiin tuotteisiin
Asetuksessa määriteltyjä vaatimuksia sovelletaan AIMD sekä MD -direktiiveissä olevien vastaavien vaatimusten sijasta, kun kyse on:
- markkinoille tulon jälkeinen valvonta
- vaaratilannejärjestelmä
- talouden toimijoiden ja laitteiden rekisteröintiä koskevat vaatimukset
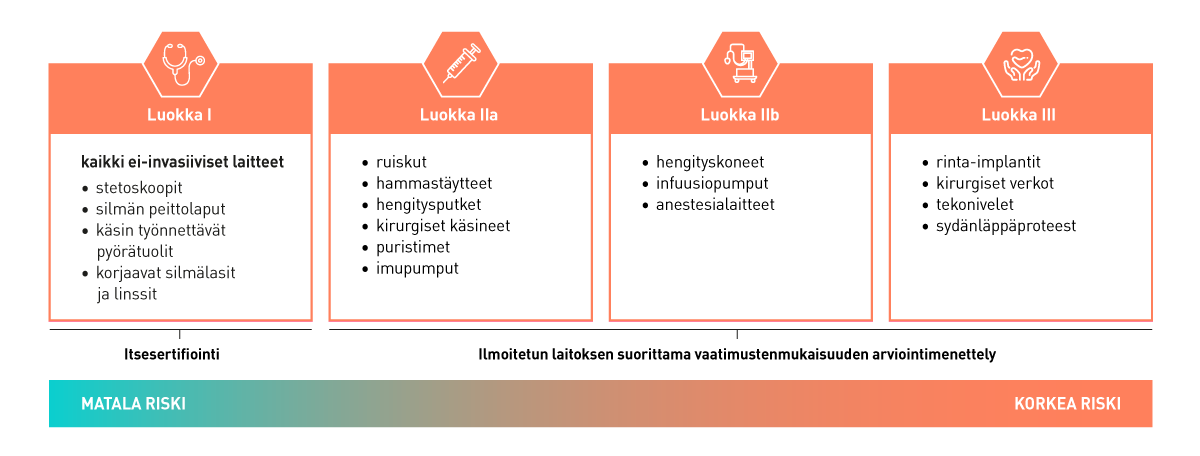
Laitteiden riskiluokittelu
Valmistajat vastaavat tuotteiden oikeasta kvalifioinnista eli määrittävät, onko kyse lääkinnällisestä laitteesta. Määrittely edellyttää laitteen käyttötarkoituksen tunnistamista ja yksilöimistä sekä laitetyypin luokittelua siihen liittyvän riskin mukaisesti.